갑상선수술 중 근전도 배경잡음: 원인, 특성 및 해결 전략
Electromyographic background noise in thyroid surgery: causes, characteristics, and mitigation strategies
Article information
Trans Abstract
Accuracy of intraoperative neuromonitoring (IONM) largely depends on the quality of electromyography (EMG) signals, which are frequently affected by background noise. EMG background noise during thyroid surgery is related to various factors including electrical interference, electrode malposition, residual neuromuscular blockade, fluid conduction, and motion artifacts. Electrical interference from electrocautery and unstable grounding, as well as poor electrode contact, were identified as the most frequent causes of background noise. Skin electrodes exhibited relatively higher baseline noise levels compared to EMG tubes or needle electrodes. Implementation of impedance monitoring, shielded cables, adaptive filters, and machine learning–based artifact classification can effectively improve the signal-to-noise ratio and diagnostic reliability of IONM. Reducing EMG background noise is critical to ensure accurate neural monitoring during thyroid surgery. Optimized threshold calibration, stable electrode fixation, and standardized intraoperative protocols are essential to minimize noise-related diagnostic errors. Future research should focus on automated noise recognition algorithms and improved electrode designs to further enhance monitoring reliability and surgical safety.
서론
갑상선수술 중 되돌이후두신경(recurrent laryngeal nerve) 및 상후두신경외지(external branch of superior laryngeal nerve)의 손상은 환자의 음성 및 기도 기능에 중대한 영향을 미친다. 이러한 합병증을 예방하기 위한 수단으로 수술 중 신경감시(intraoperative neuromonitoring, IONM)가 널리 사용되고 있다[1].
현재 임상적으로 사용되는 전극은 기관내삽관 튜브 전극(electromyography endotracheal tube electrode), 피부 부착형 전극(adhesive skin electrode), 바늘 전극(needle electrode)의 세 가지로 구분되며, 각각의 구조적⋅전기적 특성에 따라 신호 대 잡음비(signal-to-noise ratio, SNR), 진폭(amplitude), 그리고 아티팩트(artifact)의 양상이 뚜렷이 다르다.
근전도(electromyography, EMG) 신호는 일반적으로 약 30 Hz에서 3,000 Hz 사이의 대역에서 유효한 생리적 신호를 포함하지만 수술실 환경 및 신호 획득 회로에서는 다양한 주파수의 잡음 및 간섭(interference)이 존재할 수 있다. 특히 배경잡음(background noise)은 신호 해석의 정확성을 떨어뜨려 위양성(false positive) 또는 위음성(false negative) 판정을 유발할 수 있다[2]. 본 논문에서는 갑상선수술 시 IONM을 성공적으로 수행하기 위해, 전극 종류에 따른 EMG 배경잡음의 주요 원인, 발생 기전, 대처 전략, 그리고 신호 품질 향상을 위한 최신 기술적 접근법에 대해 살펴보고자 한다.
본론
1. 근전도 배경잡음의 주요 원인
1) 전기적 간섭(electrical interference)
수술실 전원선의 교류(alternating current) 성분은 60 Hz 노이즈로 직접 유입될 수 있으며, 케이블 길이와 루프 면적이 클수록 전자기 유도(electromagnetic induction)가 강화된다. 특히, 전기소작기 활성화 시 EMG 증폭기의 입력단이 포화(saturation)되어 일시적인 신호 손실이 발생할 수 있다[3]. 이를 줄이기 위해서는 전기소작기의 return electrode를 환자와 충분히 떨어진 위치에 부착하고, 모니터링 장비의 전원은 독립 회로에 연결해야 한다. 또한 최신 IONM 시스템(NIM 3.0 이후 버전)은 자동 소작 감지(auto-cautery detection) 기능을 탑재하여, 소작 신호가 감지되면 EMG 증폭을 일시적으로 차단하여 회로 보호 및 잡음 축적을 방지한다[1].
2) 전극 접촉 불량 및 위치 이상
EMG 튜브의 회전, 깊이 변화, 또는 건조한 전극면은 전기적 임피던스를 증가시켜 SNR을 감소시켜 신호 품질을 떨어뜨리는 주요 원인이다.
3) 근이완제(rocuronium) 잔존 효과
잔존 rocuronium 농도가 train of four (TOF) stimulation ratio 0.9 이하인 경우, EMG 유발 진폭은 정상 대비 30%–60%까지 감소할 수 있다. 이러한 상태에서 배경잡음이 20 μV 이상 존재하면, event threshold가 상대적으로 높게 설정되어 false loss of signal (LOS)로 오인될 가능성이 커진다. 따라서 TOF monitor와 EMG 진폭을 함께 고려하여 IONM을 유지하는 것이 중요하다[4].
4) 수분 및 체액에 의한 전도 이상
수술 중 세척액(irrigation fluid), 혈액(blood), 체액(body fluid) 등이 수술 부위에 축적되면 전극 간 전기적 전도 경로가 변화하게 된다. 특히, 전극(electrode) 사이를 연결하는 액체층(liquid bridge)이 형성되면 전류가 정상적인 근육 전도 경로를 우회하여 흐르게 되며, 이는 전류누설(shunt) 또는 단락(short circuit) 현상을 유발한다. 이러한 상황에서는 EMG 신호가 비정상적으로 증폭되거나 왜곡되어 실제 신경 자극 반응과 무관한 비생리적 잡음(artifactual noise)이 발생한다[5]. 예를 들어, EMG endotracheal tube (EMG-ETT) 전극 표면에 세척액이 묻은 채 양극과 음극이 모두 젖어 있으면, 두 전극 간의 저항(resistance)이 급격히 감소하여 전위차(potential difference)가 거의 0에 수렴한다. 이때 증폭기(amplifier)는 “flat” 신호 또는 pseudo-spike artifact를 출력할 수 있다. 이러한 오류는 특히 피부 부착형 전극에서 흔하게 발생한다[5].
2. 배경잡음의 주파수 특성과 분석
EMG 신호는 일반적으로 30–3,000 Hz 대역에서 유효한 생리적 신호를 포함하나, 배경잡음은 주로 50–60 Hz (전원 주파수 잡음), 0–20 Hz (저주파 drift), 3,000 Hz 이상(고주파 전자기 간섭) 영역에서 두드러진다.
따라서 EMG 신호 획득 및 분석 시에는 notch filter (60 Hz 혹은 50 Hz)를 통해 전원 잡음(power-line noise)을 제거하고, band-pass filter (예: 30–3,000 Hz)를 적용함으로써 생리적 신호 대역(physiological frequency band)을 확보하는 것이 필수적이다. Notch filter는 협대역(narrow-band) 감쇠 필터로서, 특정 주파수(예: 60 Hz)에서 이득(gain)을 0 dB 이하로 낮추어 전원 간섭을 효과적으로 억제한다. 그러나 notch filter의 대역폭(bandwidth)이 지나치게 넓으면 그 인근의 생리적 신호(예: 60±10 Hz 범위)까지 동시에 감쇠시키게 되어 신호 감쇠(signal attenuation) 또는 ringing artifact를 유발할 수 있다. 이러한 현상을 방지하기 위해 최근에는 adaptive notch filtering 알고리즘이 적용되어 전원 주파수가 미세하게 변동되더라도 자동으로 notch 중심 주파수를 추적하여 노이즈만 선택적으로 제거한다[6].
Band-pass filter는 저주파와 고주파를 동시에 제한하여 EMG 신호의 핵심 대역(30–3,000 Hz)을 통과시키는 역할을 한다. 저주파 차단부(low-cut section)는 전극-피부 계면의 전위 변동(skin–electrode potential fluctuation)과 기계적 움직임(motion artifact)을 억제하지만 cutoff frequency를 너무 높게 설정하면 근육 수축 초기의 저주파 성분(low-frequency components of motor unit action potential)이 제거되어 신호의 rise-time이 비정상적으로 짧아진다. 반대로 고주파 차단부(high-cut section)를 지나치게 낮게 설정하면(예: 2,000 Hz 이하), EMG 신호의 급격한 파형(transient component)이나 biphasic morphology가 완화되어 신호의 진폭과 주기(periodicity) 분석 정확도가 떨어진다[7].
실제 수술 중에는 다양한 전자기 간섭이 복합적으로 작용하므로 고정된 필터 설정만으로는 한계가 있다. 이에 따라 적응형 필터(adaptive band-pass filtering)나 웨이블릿 기반 잡음 제거(wavelet-based denoising) 기법이 개발되어 시간-주파수(time–frequency) 변화에 따라 실시간으로 필터 특성을 조정할 수 있다. 적응형 필터(adaptive filter)는 배경잡음의 전력(power spectrum)이 변할 때마다 EMG의 SNR을 최적화하도록 필터 파라미터를 갱신하여 특히 전기소작기 사용 시와 같이 순간적인 노이즈 스파이크(spike-like noise)가 발생할 때 매우 유용하다[8].
결과적으로, 필터의 설계와 적용은 단순히 노이즈를 제거하는 절차를 넘어 신호 왜곡(signal distortion)을 최소화하면서 진정한 생리적 파형을 유지하는 과정이라 할 수 있다. EMG의 해석 정확도는 이러한 균형(balancing)에 크게 의존하므로 필터의 중심 주파수(center frequency), 대역폭, 감쇠율(atttenuation rate) 등을 수술 환경과 전극 종류(EMG tube vs. skin electrode)에 맞게 표준화할 필요가 있으며, 이는 임상의사와 공학자의 협업으로 이뤄질 수 있다.
3. 전극 종류에 따른 잡음 특성 비교
전극의 종류는 EMG 신호의 품질(signal quality)과 잡음 특성(noise characteristics)에 직접적인 영향을 미친다. 현재 갑상선수술에서 널리 사용되는 전극은 EMG-ETT, 바늘 전극, 그리고 피부 부착형 전극이며, 각각의 구조적⋅전기적 특성에 따라 SNR과 잡음 발생 양상이 다르다.
1) 기관내삽관 튜브 전극
EMG-ETT는 전극이 기관내삽관 튜브의 표면에 부착되어 성대근(vocalis muscle)과 직접 접촉하는 구조로, 높은 진폭(amplitude)와 우수한 전도성(contact conductivity)을 제공한다[1,9,10]. 직접 접촉 방식으로 인해 전류 경로가 짧고 전도저항이 낮아 고주파수 전원 잡음(50–60 Hz power-line noise)이나 기계적 진동에 의한 아티팩트가 상대적으로 적다. 다만 전극이 점액, 혈액 등에 의해 오염되거나 튜브의 위치가 변동되면 접촉저항(contact impedance)이 급격히 변화하여 intermittent contact noise 또는 baseline drift가 발생할 수 있다. 특히 수술 중 기도 내 위치 변화나 튜브 회전(rotation)에 의해 접촉저항이 급격히 변동하면서 순간적 “spike-type artifact”가 나타날 수 있다(Figure 1A).
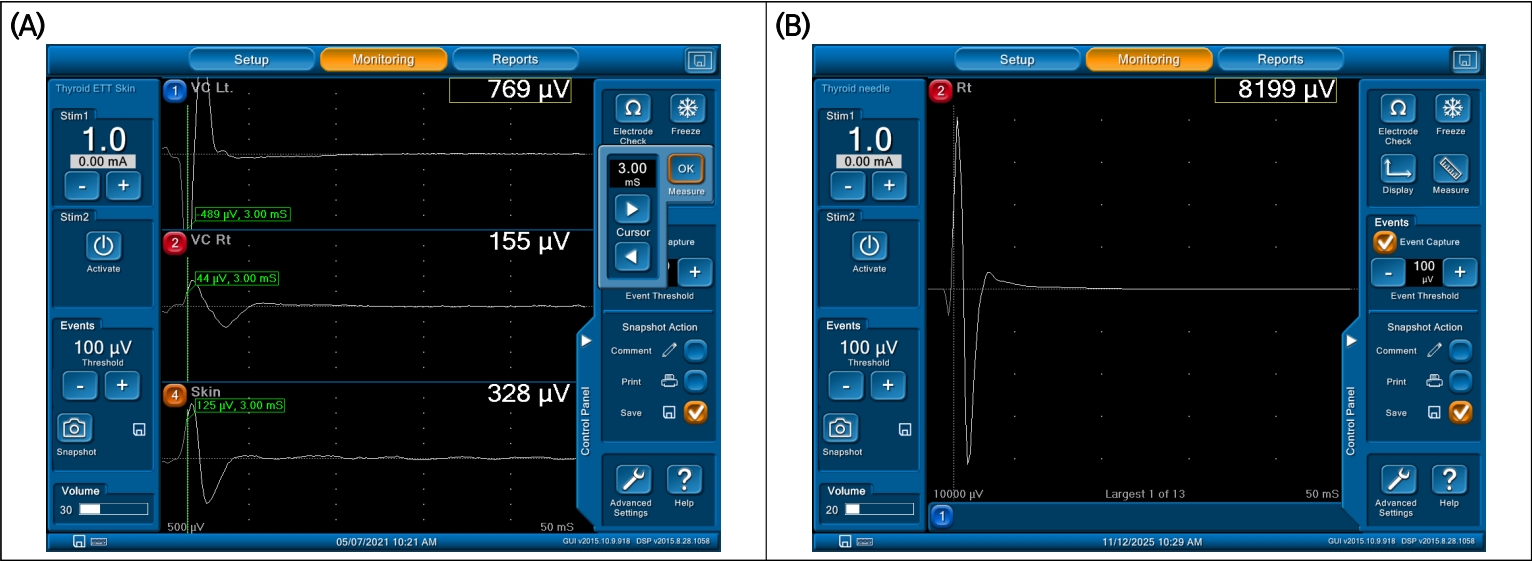
Representative EMG waveforms and background noise patterns by electrode type. (A) EMG-ETT electrode showing high amplitude (700–1,000 μV) with stable baseline (electrode no. 1, at the topmost location). Adhesive skin electrode showing typical biphasic, but relatively low-amplitude (100–300 μV) signals (electrode no. 4, at the bottommost location). (B) Needle electrode showing sharp biphasic morphology and minimal artifact with most high amplitude. EMG, electromyography; ETT, endotracheal tube electrode.
2) 바늘 전극
바늘 전극은 근육 내에 직접 삽입되어 전위를 측정하므로 가장 높은 SNR과 우수한 전기적 접촉 안정성을 보인다[11]. 전극이 근육 조직 내부에 위치하기 때문에 외부 전자기 간섭이나 피부 표면의 움직임에 의한 기계적 움직임이 거의 없다. 따라서 진폭이 크고 파형 형태가 명확하며, 위음성 판정 가능성이 낮다[11,12]. 그러나 침습적 특성상 출혈, 감염, 전극 이동에 따른 신호 불안정 위험이 존재하고, 전극의 미세한 움직임이나 근육 긴장도 변화에 따라 근내 잡음(intramuscular noise)이 발생할 수 있다(Figure 1B).
3) 피부 부착형 전극
피부 부착형 전극은 비침습적이며 적용이 용이하지만 전극-피부 사이에 존재하는 피부 저항(skin impedance)과 각질층(corneal layer) 때문에 고주파 잡음에 취약하다. 또한 피부의 움직임, 전극의 미세한 위치 변화, 땀이나 수술용 소독액의 잔류 등으로 인해 저주파 대역의 기계적 움직임과 high-frequency thermal noise가 혼재될 수 있다. 결과적으로 skin electrode에서 기록되는 EMG는 평균 진폭이 낮고(baseline amplitude ↓), SNR이 낮으며, 배경잡음의 변동성이 크다[13]. 따라서 동일한 event threshold (예: 100 µV)를 적용할 경우, 실제 생리적 파형이 노이즈로 묻히거나 LOS로 오인될 가능성이 있다(Table 1, Figure 1A).
4) 잡음이 intraoperative neuromonitoring 해석(loss of signal 판단, threshold 설정)에 미치는 영향
Threshold가 낮으면 배경잡음이 신호로 인식될 수 있고, 반대로 threshold가 높으면 정상적인 유발 EMG 신호가 무시되어 false LOS로 판단될 가능성이 있다. 바늘 전극이나 EMG-ETT의 경우 이전 선행연구들을 바탕으로 event threshold가 100 µV로 정립되어 있으나 피부 부착형 전극의 경우 유발 진폭 값이 상대적으로 낮아 threshold를 100 µV 그대로 적용하는 것이 맞는지에 대해서는 정립되어 있지 못한 실정이다. 이에 대해서는 향후 보완 연구가 필요하다고 생각된다.
결론
갑상선수술 중 EMG 배경잡음은 IONM의 진단 정확도를 저해하는 핵심 요인으로, 전기적 간섭, 전극 접촉 불량, 근이완제 잔존 효과, 체액 전도, 그리고 움직임 아티팩트 등 다양한 기전이 복합적으로 작용한다. 특히 전극 종류에 따라 잡음의 형태와 민감도가 다르며, EMG-ETT 전극은 안정적이지만 위치 변화에 민감하고, 바늘 전극은 SNR이 가장 높으나 침습적이며, 피부 부착형 전극은 비침습적이지만 잡음 수준이 높아 신호 해석의 한계가 존재한다. 향후 연구는 SNR 향상, 자동 노이즈 식별 알고리즘 개발, 전극 디자인 개선 등으로 나아가야 하며, 이를 위해서는 (1) 고성능 GPU가 필요한 연산 부담, (2) 개별 IONM 시스템 간 하드웨어 차이에 따른 일반화 한계, (3) intraoperative validation 부족 등의 한계점을 극복해야 하는 문제가 있다. 그러나 이러한 연구를 통하여 수술 중 신경 손상 예방 및 IONM의 기술 향상에 기여할 수 있을 것으로 생각된다.
Notes
Funding
None.
Conflict of Interest
No potential conflict of interest relevant to this article was reported.
Data Availability
None.
Author Contributions
All work was done by SCS.

